ХИМИЧЕСКИЙ ЗВ’СВЯЗЬ
2. Типы химической
связи
При
образовании химической связи атомы, участвующие в нем, стараются приобрести
конфигурации инертного газа. Поскольку при этом задействованы лишь оболочки валентных
электронов, то для изображения атома используют так называемую формулу Льюиса, в
которой изображены только валентные электроны.
Пример.
Изображения электронного строения атома Натрия и атома Хлора и их запись в виде
формулы Льюиса
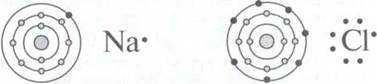
Соответственно,
в изображении учитываются только те орбитали, электроны которых участвуют в
образовании химической связи.
Внимание:
для описания химической связи используют как формулу Льюиса, так и изображения
орбиталей.
2.1. Ионная связь
Чтобы
создать конфигурацию инертного газа, оболочка валентных электронов атома может
терять или принимать электроны. При этом образуются положительно или отрицательно
заряженные ионы.
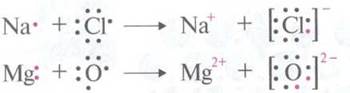
Между
ионами, которые имеют разные заряды, происходит сильное электростатическое взаимодействие.
Поэтому ионные соединения в твердом состоянии образуют устойчивую ионную кристаллическую решетку.
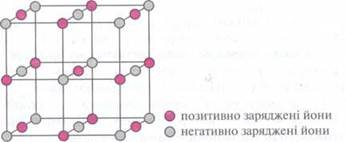
Запомните:
все соли, большинство оксидов активных металлов и их гидроксидов образуют ионную
кристаллическую решетку. Вследствие сильного электростатического взаимодействия эти вещества по
нормальных условиях (н.у.) твердые и имеют высокую температуру плавления.
Пример.
Натрий хлорид имеет температуру плавления 801 °С, магний оксид - температуру
плавления 2832 °С.