Часть II.
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Раздел 8. ВОДОРОД.
ГАЛОГЕНЫ
§
8.1. Общие свойства неметаллов
Для неметаллов скорее характерна
различие, чем общность свойств. Поэтому в учебниках конечно нет
общий обзор неметаллов. Однако это не означает, что такой общей оценки
свойств нельзя дать.
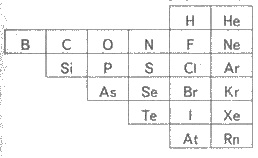
Чтобы обнаружить свойства, характерные
для всех неметаллов, нужно прежде всего обратить внимание на их расположение в
периодической системе элементов Д. И. Менделеева и определить число электронов на
внешнем энергетическом уровне атомов. Неметаллы в основном размещаются в
концы малых и больших периодов, а число внешних электронов в их атомах, как и
во всех атомов элементов главных подгрупп равна номеру группы. Как известно,
способность к присоединению электронов в периоде возрастает по мере приближения к
благородного газа, а в группе - по мере уменьшения радиуса атома или, другими
словам, снизу вверх.
Для завершения внешних электронных
уровней атомы неметаллов присоединяют электроны и являются окислителями. Активнее
присоединяет электроны атом фтора. У остальных элементов неметаллов, которые изучаются в
средней школе, эта способность уменьшается в таком порядке: O, Cl, N, S, С, Р, Н, Si. У атомов этих элементов уменьшение
способности к присоединению электронов соответствует уменьшению значений их относительных
электроотрицательностей (см. табл. 2.2). Следует отметить, что вторым в этом ряду
после фтора стоит атом кислорода, а не хлора.
Взаимодействуя с металлами, типовые
неметаллы образуют соединения с ионным типом связи, например хлорид натрия NaCl, оксид калия K2S. При определенных условиях неметаллы взаимодействуют
между собой, образуя соединения с ковалентным типом связи - как полярные, так и не
полярные. Примером первых является вода Н2О,
хлороводень
НСl, аммиак NH3, примером вторых - оксид карбона(ИV) СО2, метан СН4,
бензол С6Н6.
С гідрогеном неметаллы образуют
летучие соединения, как, например, фтороводорода HF, сероводород H2S, аммиак NH3, метан СН4. Во время
растворение в воде водородные соединения галогенов, серы, селена и теллура
образуют кислоты с такой же формуле, что и сами водородные соединения: HF, НСl, НВr, Hl, H2S, H2Se, H2Том.
Во время растворения в воде аммиака
образуется аммиачная вода, что конечно сказывается формуле NH4OH и называется гидроксидом амонію. ее
также обозначают формулой NH3 ∙ Н2О и называют
гідратом аммиака (см. § 10.3).
С оксигеном неметаллы образуют
кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления,
что равна номеру группы (например SO3, N2O5), в других
-
ниже (например, SO2, N2O3). Кислотным оксидам соответствуют
кислоты, причем с двух кислородсодержащих кислот одного металла сильнее будет и, в
которой он проявляет высшую степень окисления. Например, азотная кислота HNO3 сильнее, чем нітритна HNO2, а сульфатная кислота H2SO4 сильнее, чем сульфитная H2SO3. Напомним, что сила кислоты
определяется способностью образовывать ионы водорода Н (точнее, Н3О+
).
При нормальных условиях неметаллы водород,
фтор, хлор, кислород, азот и благородные газы - это газы, бром - жидкость, а остальные -
твердые вещества.
Отдельно следует сказать о химии
благородных газов. их атомы содержат на внешнем уровне по 8 электронов (в
гелия 2). Ранее считалось, что такие атомы не способны ни отдавать электроны, ни
присоединять их, ни образовывать общие электронные пары. Однако в 1962 г. была
добыта первая химическое соединение благородного газа - тетрафторид ксенона XeF4, после чего химия благородных газов
начала развиваться быстрыми темпами. Особенно богата химия ксенона, соединения
которого по свойствам подобны соответствующих соединений йода.
При взаимодействии ксенона с фтором
в зависимости от условий эксперимента образуется или дифторид ксенона XeF2, или тетрафторид XeF4, или гексафторид XeFe. При нормальной температуре все эти
соединения - твердые вещества белого цвета. С химической точки зрения самый активный
гексафторид ксенона XeF6. Он легко взаимодействует с кремнеземом
(оксидом кремния(ИV)):
2XeFe + SiO2 = 2XeOF4 + SiF4.
Окситетрафторид ксенона XeOF4, при этом образуется, по
нормальной температуры - летучая бесцветная жидкость.
Все фториды ксенона взаимодействуют с
водой. При этом в реакции с дифторидом и тетрафторидом образуются ксенон,
кислород и фтороводорода:
2XeF4 + 2Н2О = 2Хе + О2
+ 4HF;
XeF4 + 2Н2О = Хе + О2
+ 4HF.
Однако при взаимодействии с водой
гексафторида образуется новое соединение - оксид ксенона(VИ):
XeFe + ЗН2О = ХеО3
+ 6HF.
Оксид ксенона(VИ) ХеО3 - это бесцветная
кристаллическое вещество, которое в твердом состоянии весьма взрывоопасная (по силе она
не уступает тринітротолуолом). В растворе же оксид ксенона(VИ) устойчив и безопасен.
Фториды ксенона - сильные окислители.
При взаимодействии с водородом они восстанавливаются до ксенона. Поэтому, например,
реакция
XeF6 + ЗН2 = Хе + 6HF
используется
для добывания чистого ксенона.
Фториды ксенона проявляют окислительные
свойства также относительно других соединений, например:
XeF6 + 6Кl = Хе + 3l2 + 6KF.
После фторидов ксенона удалось
добыть и фторид радона. Однако вследствие сильной радиоактивности радона эта
соединение мало изучена. Добыто также фториды криптона KrF2 и KrF4, которые тоже оказались значительно менее
устойчивыми, чем соответствующие соединения ксенона. Соединения же неона, аргона и гелия не
добыто.
Из кислородсодержащих соединений, кроме оксида
ксенона(VИ)
ХеО3, добыто оксид ксенона(VIII) ХеO4, а также соответствующие им кислоты - Н6ХеО6
и Н4ХеО6 . Хотя сами эти кислоты неустойчивы, их соли -
ксенати (например, Na4XeO6, Ва3ХеО6) и
перксенати (например, Ма6ХеО6, Ва2ХеО6)
- при комнатной температуре являются достаточно устойчивыми кристаллическими веществами. Добыто
также соли криптонової кислоты - криптат бария ВаКrO4 и др.
Итак, благородные газы способны
вступать в реакции и образовывать соединения с обычными ковалентними связями.
Вместе с тем уже известны также химические
соединения благородных газов с ионным зв'язком. их удалось добыть, используя
для отщепления электронов от атомов гексафторид платины PtF6 - газ темно-красного цвета, что является
даже сильнее окисником, чем фтор. Уравнение реакции взаимодействия ксенона с гексафторидом
платины можно изобразить так:
Хе + PtF6 = Хе+ [PtF6]-.
Гексафторплатинат ксенона, который
образовался, - твердое вещество оранжевого цвета, имеет ионную кристаллическую
решетку.
Химия инертных элементов - это
достижения науки последних двух десятилетий.
Ниже рассматриваются общие
характеристики свойств элементов за теми главными подгруппами, в которых
относятся неметаллы. Это подгруппы галогенов, кислорода, азота, углерода. Отдельно
рассматривается только водород.