РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
6. Смеси веществ. Растворы
6.6. Электролитическая диссоциация
6.6.3. Степень электролитической диссоциации
Растворы могут состоять из частиц растворителя, растворенного вещества и продуктов их взаимодействия, а следовательно, в растворах электролитов могут диссоциировать не все, а лишь часть молекул. Количественной характеристикой процесса диссоциации является степень диссоциации (измеряется в 0,1 М водном растворе).
Степень диссоциации а («альфа») - это отношение числа диссоциированных молекул п к общему числу молекул электролита в растворе N. Размерность α - % или доля единицы:
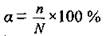
По этому показателю электролиты разделяют на сильные, средней силы и слабые.
Сильные электролиты диссоциируют в значительной степени (α > 30 %) даже в концентрированных растворах. К ним относятся:
а) большинство неорганических кислот (H2SО4, HNO3, НСlO4, НСlO3, НСl, НВr, НИ, НМnO4);
б) щелочи (гидроксиды щелочных и щелочноземельных металлических элементов);
в) растворимые соли:
• все соли с катионами щелочных металлических элементов и с катионами аммония NH4+;
• почти все хлориды (исключение - AgCl и РbСl2);
• нитраты и нитриты всех металлических элементов.
Электролиты средней силы (α = 3-30 %)1: Н3РO4, H2SO3.
Слабые электролиты диссоциируют частично (α 3 %) даже в разбавленных растворах. К ним относятся:
а) почти все органические кислоты;
б) некоторые неорганические кислоты (HF, НСlO, HNO2, Н3РО3), часть из которых являются летучими (Н2СO3, H2S);
в) основы - мало - и нерастворимые в роде гидроксиды металлов, аммоний гидроксид NH4OH, а также вода Н2O;
г) малорастворимые соли (BaSO4, CaSO4).
Степень электролитической диссоциации вещества зависит от его природы, природы растворителя, концентрации и температуры раствора. При снижении концентрации электролита, т.е. при разбавлении раствора степень диссоциации увеличивается, потому что увеличивается расстояние между ионами в растворе, вследствие чего уменьшается возможность совмещения их в молекулы. При повышении температуры степень диссоциации, как правило, тоже повышается.