РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
6. Смеси веществ. Растворы
6.6. Электролитическая диссоциация
6.6.2. Основные положения теории электролитической диссоциации
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы. В растворах или расплавах электролитов ионы движутся хаотически.
2. Под действием электрического поля (разности потенциалов) движение ионов приобретает направленности: положительно заряжеными ионы движутся к отрицательно заряженному катоду, их называют катионами (К+,Na+, Fe2+, Zn2+, Al3+); отрицательно заряженные - к аноду, их называют анионами (Сl-, S2-, SO42-, NO3-, РО43-).
Ионы бывают: .
• простые (К+, Na+, Сl-) и сложные (NH4+, NO3-, SO42-);
• бесцветные (Сl-, К+, Na+) и окрашенные (МnО4- имеет малиновый цвет, СrO42- - желтый).
Некоторые ионы оказывают раствора определенный вкус: Н+ - кислый, Ве2+ и Рb2+ - сладкий, Mg2+ - горький, Na+, Сl- вместе (Na+ > Сl-) обусловливают соленый вкус.
Растворы электролитов, кроме электропроводности, имеют еще ряд свойств, которые их отличают от растворов неэлектролита (осмотическое давление, температуры плавления и кипения, давление пара и т.д.).
3. Электролитическая диссоциация - процесс обратимый.
Это означает, что одновременно происходят оба процесса: расщепление молекул на ионы (диссоциация) и соединение ионов в молекулы (ассоциация). Это касается диссоциации кислот - электролитов, которые имеют молекулярное строение.
В отличие от кислот, соли и щелочи - это йонни вещества; во время их растворения ионы отделяются от кристалла и переходят в раствор. Во время обратного процесса происходит не соединение ионов в молекулы (ведь молекул солей и щелочей не существует), а формирование кристалла (нового или восстановления старого). Поэтому все отделены от кристалла частицы являются диссоциированными, диссоциация солей и щелочей является полной и необратимой.
В уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости 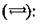
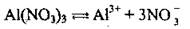
Это уравнение показывает, что при диссоциации формульной единицы алюминий нитрата образуется 4 ионы: один Al3+ и три NО3-.
4. Общая сумма зарядов (положительных и отрицательных) равна нулю, а поэтому раствор электролита в целом является електронейтральним.