РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
6. Смеси веществ. Растворы
6.6. Электролитическая диссоциация
В зависимости от своей природы вещества по-разному растворяются в воде. Вещества с атомными кристаллическими ґратками являются чрезвычайно устойчивыми и в воде не растворяются. Много веществ с молекулярными кристаллическими решетками (с неполярным ковалентной связью) растворяется в воде, распадаясь до молекул - електронейтральних частинок. их растворы не содержат носителей электрического заряда и, соответственно, не могут проводить электрического тока. Итак, неелектроліти - это вещества, которые в растворенном или расплавленном состоянии не проводят электрического тока.
Значительная часть веществ с молекулярными кристаллическими ґратками, образованных с помощью полярной ковалентной связи (имеют полярные молекулы), много веществ с ионными кристаллическими решетками при растворении в полярном растворителе (например, воде) распадается на ионы - происходит электролитическая диссоциация2. Диссоциации в растворах подвергаются вещества с ионным и ковалентным полярным связью, в расплавах - только с ионным.
__________________________________________________________
1 Газовые гидраты (клатраты), в которых «гостями» выступают молекулы газов или летучих жидкостей (O2, N2, Аr, Хе, Вr2, Cl2, SF6, H2S, СН4, С3Н8, СНСl3 и т.д.), а «хозяевами» - молекулы воды, которые образуют кристаллический каркас. Они напоминают снег или лед, но могут существовать при положительных температурах.
2 Классическую теорию электролитической диссоциации создали 1887 г. С. Аррениус (1859-1927) и В. Ф. Оствальд (1853 - 1932). Последователь Д. И. Менделеева И. О. Каблуков (1857-1942) дополнил теорию идеей гидратации ионов.
6.6.1. Механизмы электролитической диссоциации в водном растворе
Во время растворения вещества в воде происходит гидратация - окружение полярных молекул или ионов диполями воды.
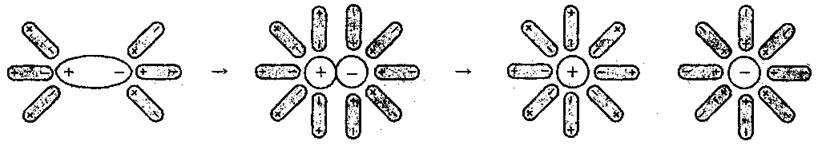
1. Диссоциация полярных молекул (диполь-дипольный механизм).
Дипольные (полярные) молекулы электролита при растворении его в воде взаимодействуют с полярными молекулами воды. Так, например, в молекуле хлороводорода НСl под влиянием этого взаимодействия изменяется характер связи: связь Н-Cl становится еще более полярным и постепенно превращается в ионный. Ионы Н+ и Сl-, переходят в раствор, связываются с молекулами воды, образуя гидратированные ионы:
2. Диссоциация электролитов с йонним типом связи (ион-дипольный механизм).
Легче всего диссоциируют в воде вещества с йонним связью. Полярные молекулы воды ориентируются соответствующим образом вокруг частиц растворенного в воде электролита, что приводит к ослаблению связей между положительно и отрицательно заряженными ионами, которые содержатся на поверхности кристалла. Как результат, связи разрываются, образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды:
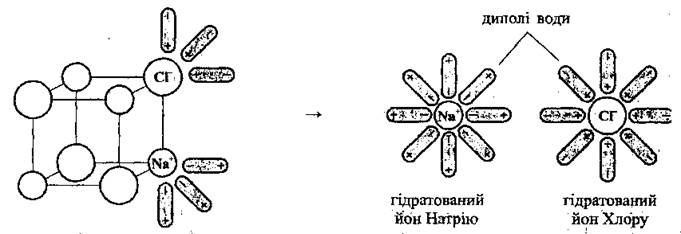
Процесс распада, но без участия молекул воды, происходит и во время расплавления этих веществ (когда кинетическая энергия ионов превышает энергию взаимодействия ионов в кристалле). Такие вещества называют электролитами.
Электролиты - это вещества, которые в растворенном или расплавленном состоянии способны проводить электрический ток. К ним относятся растворы (расплавы) кислот, щелочей и солей . Это проводники второго типа, то есть сами в себе при обычных условиях тока они не проводять. их электропроводность обусловлена наличием ионов, из которых они частично или полностью состоящие в растворах и расплавах.
|
|
Электролиты
|
Неелектроліти
|
|
химические связи
|
йонни или ковалентные сильно полярные
|
ковалентные, мало полярные , или ковалентные неполярные
|
|
примеры соединений
|
соли (КСl, Na2SO4, K2PO4), кислоты (НСl, H2SO4, HNO3), щелочи (KВОН, Ва(ОН)2)
|
органические вещества (углеводороды, углеводы, спирты, альдегиды, эфиры)
|