Часть И. ОБЩАЯ
ХИМИЯ
Раздел 3. ХИМИЧЕСКИЙ
СВЯЗЬ
§
3.7. Типы кристаллических решеток
Твердые вещества, как правило, имеют
кристаллическое строение. Она характеризуется правильным расположением частиц в
четко определенных точках пространства. При мысленном соединении этих точек прямыми
линиями, которые пересекаются, образуется пространственный каркас, который называют
кристаллической решеткой. Точки, в которых размещены частицы, называются узлами
кристаллической решетки. В узлах воображаемой решетки Могут находиться ионы, атомы
или молекулы. Они совершают колебательное движение. С повышением температуры
амплитуда колебаний увеличивается, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и
характера связи между ними различают четыре типа кристаллических решеток: ионные,
атомные, молекулярные и металлические.
Кристаллические решетки, состоящие
из ионов, называются іонними. их образуют вещества с ионными связями.
Примером может быть кристалл хлорида натрия, в котором, как уже отмечалось, каждый
ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами
натрия. Такому размещению отвечает самая плотная упаковка, если ионы представить в
виде шаров, размещенных в кристалле (рис. 3.15). Очень часто кристаллические решетки
изображают так, как показано на рис. 3.16, где указано лишь взаимное размещение
частиц, но не их размеры.
Число ближайших соседних частиц,
плотно присоединяются к данной частицы в кристалле или в отдельной молекуле,
называется координационным числом.
В решетке хлорида натрия
координационные числа обоих ионов равны 6. Следовательно, в кристалле хлорида натрия
невозможно выделить отдельные молекулы соли. их нет. Весь кристалл следует рассматривать
как гігантськумакромолекулу, состоящая из одинакового числа ионов Na+ и Сl- , NanCln, где n - большое число (см. рис. 3.15).
Связи между ионами в таком кристалле достаточно прочные. Поэтому вещества с ионной
решеткой имеют сравнительно высокую твердость. Они тугоплавкие и малолеткі.
Плавления ионных кристаллов вызывает
в нарушение геометрически правильной ориентации ионов относительно друг друга и
уменьшение прочности связи между ними. Поэтому их расплавы проводят электрический
ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих
из полярных молекул, например в воде.
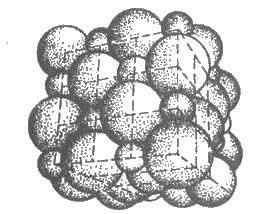
Рис. 3.15. Пространственное размещение
ионов в ионной решетке NaCl (мелкие
шарики - ионы натрия)
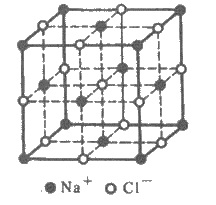
Рис. 3.16. Кристаллическая решетка NaCl
Кристаллические решетки,в узлах которых
размещаются отдельные атомы, называются атомными. Атомы в таких решетках
соединенные между собой прочными ковалентними связями. Примером может служить алмаз -
одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых
связан с четырьмя соседними атомами. Координационное число углерода в алмазе -
4. Структура алмаза представлена на рис. 11.1. В решетке алмаза, как и в решетке
хлорида натрия, молекул нет. Весь кристалл следует рассматривать как гигантскую
молекулу. В неорганической химии известная значительное количество веществ с атомной
кристаллической решеткой. Они имеют высокие температуры плавления (для алмаза
свыше 500°С), крепкие и твердые, практически не растворимые в жидкостях. Атомная
кристаллическая решетка характерна для твердого бора, кремния, германия и соединений
некоторых элементов с карбоном и силіцієм. Кристаллические решетки,
состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми
межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую
твердость, низкие температуры плавления, нерастворимые или малорастворимые в воде,
их растворы почти не проводят электрического тока. Число неорганических веществ с
молекулярной решеткой незначительное. Примерами их являются лед, твердый оксид углерода(ИV) (“сухой лед”), твердые
галогеноводні, твердые простые вещества, образованные одно- (благородные газы), двух-
(F2, Сl2, r2, l2, Н2, О2, N2), трех- (О3), четырех-
(Г4), восьми- (S8)
атомными молекулами. Молекулярная кристаллическая решетка йода представлена на рис. 3.17.
Большинство кристаллических органических соединений имеют молекулярную решетку.
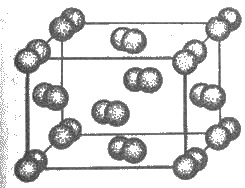
Рис. 3.17. Кристаллическая решетка йода
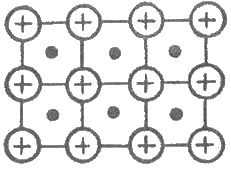
Рис. 3.18. Схематическое изображение
металлической решетки
В твердом состоянии металлы образуют
металлические кристаллические решетки. Последние обычно описывают как сочетание катионов
металла, соединенных в одно целое валентными электронами, то есть негативно
заряженным “электронным газом”. Электроны электростатически притягиваются катионами,
что обеспечивает стабильность решетки. На рис. 3.18 представлено схематическое изображение
металлической решетки. На рис. 3.18 представлено схематическое изображение металлической
решетки (свободные электроны изображены точками). Сравните ее с другими типами
кристаллических решеток.