Часть И. ОБЩАЯ
ХИМИЯ
Раздел 3. ХИМИЧЕСКИЙ
СВЯЗЬ
§
3.5. Металлическая связь
Атомы большинства металлов на
внешнем энергетическом уровне содержат небольшое число электронов. Так, по
одному электрону содержит 16 элементов, по два - 58, по три - 4 элементы и
ни одного - только Pd. Атомы
элементов Ge, Sn и
Pb имеют на
внешнем уровне по 4 электрона, Sb и Bi - 5, Ро - 6, но эти элементы
не являются характерными металлами.
Элементы металлы образуют простые
вещества - металлы. При обычных условиях это кристаллические
вещества (кроме ртути). На рис. 3.14
изображен кристаллическую решетку натрия. Как видим, каждый атом натрия окружен
восемью соседними. На примере рассмотрим натрия
природу
химической связи в металлах.
У атома натрия, как и в других
металлов, является избыток валентных орбиталей и недостаток электронов. Так, валентный
электрон (3s1) может
занимать одну из девяти свободных орбиталей - 3s
(одна), 3р (три) и 3d
(пять). Во время сближения атомов в результате образования кристаллической решетки
валентные орбитали соседних атомов перекрываются, в результате чего электроны
свободно перемещаются из одной орбитали на другую, осуществляя связь между всеми
атомами кристалла металла. Такой тип химической связи называется металлической
связью. Металлическая связь образуют элементы, атомы которых на внешнем
уровне имеют мало валентных электронов по сравнению с общим числом внешних
энергетически близких орбиталей, а валентные электроны вследствие небольшой
энергии ионизации слабо удерживаются в атоме. Химическая связь в металлических
кристаллах сильно делокалізований, т.е. электроны, осуществляющие связь, обобщенные
(“электронный газ”) и перемещаются по всему куску металла, который в целом
електронейтральний.
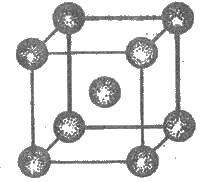
Рис. 3.14. Кристаллическая решетка
натрия
Металлическая связь характерна для
металлов в твердом и жидком состояниях. Это свойство агрегатов атомов,
размещенных в непосредственной близости друг от друга. Однако в парообразном
состоянии атомы металлов, как и всех веществ, соединенные между собой ковалентними
связями. Пара металлов состоит из отдельных молекул (одно - и двухатомными). Прочность
связи в кристалле больше, чем в молекуле металла, а потому процесс образования
металлического кристалла происходит с выделением энергии.
Металлическая связь несколько подобный
ковалентной, так и в его основе лежит обобществление валентных
электронов. Однако электроны, которые осуществляют ковалентная связь, находятся
вблизи соединенных атомов и прочно с ними связаны. Электроны же, которые осуществляют
металлическая связь, свободно перемещаются по всему кристаллу и принадлежат всем
его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлическим -
пластичны, то есть они меняют форму во время удара, прокатку в тонкие листы
и вытягиваются в проволоку.
Металлическим связью объясняются
физические свойства металлов (см. § 12.2).