Часть И. ОБЩАЯ
ХИМИЯ
Раздел 1. ОСНОВНЫЕ
ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
§
1.11. Газовые законы. Закон Авогадро. Молярный объем газа
Поскольку газы является самым простым
объектом для исследования, то их свойства и реакции между веществами газуватими
изучено наиболее полно.
Французский ученый Ж. Л. Гей-Люссак установил
закон объемных отношений:
объемы газов, вступающих в реакцию
при одинаковых условиях (температура и давление), относятся между собой как простые целые
числа.
Например, 1 л хлора соединяется с
1 л водорода, образуя 2 л хлороводорода; 2 л оксида серы(ИV) сопрягаются с 1 л кислорода,
образуя 2 л оксида серы(VИ).
Этот закон дал возможность итальянском
ученому А. Авогадро предположить, что молекулы простых газов (водорода, кислорода, азота,
хлора и других) состоят из двух одинаковых атомов. Во время соединения водорода с
хлором их молекулы распадаются на атомы, а последние образуют молекулы
хлороводорода. Но поскольку из одной молекулы водорода и одной молекулы хлора
образуются две молекулы хлороводорода, то и объем последнего должен быть равен сумме
объемов исходных газов, т.е.
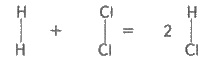
или
Н2 + Сl2 = 2НСl.
Следовательно, объемные отношения легко
объясняются, если исходить из представления о двохатомність молекул простых газов
(Н2, Сl2, O2, N2 и другие). Это, в свою очередь,
доказательством двохатомності молекул этих веществ.
Изучение свойств газов дало
возможность А. Авогадро выдвинуть гипотезу, которая впоследствии была подтверждена исследовательскими
данным, а поэтому названная законом Авогадро:
в равных объемах различных газов при
одинаковых условиях (температура и давление) содержится одинаковое количество молекул.
Из закона Авогадро вытекает важное
следствие: при одинаковых условиях 1 моль любого газа занимает одинаковый объем. Этот
объем можно вычислить, если известна масса 1 л газа. При нормальных условиях, то есть за
температуры 273 К (0°С) и давлении 101 325 Па (1 атм), масса 1 л водорода равна
0,09 г, молярная масса его равна 1,008 ∙ 2 = 2,016 г/моль. Тогда объем, что его занимает 1 моль
водорода, равна:
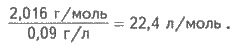
При этих же условиях масса 1 л кислорода
равна 1,429 г; молярная масса - 32 г/моль. Тогда объем равен:
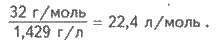
Это означает, что при нормальных условиях 1
моль различных газов занимает объем, равный 22,4 л. Этот объем называется
молярным объемом газа1.
Молярный объем газа - это отношение
объема вещества к количеству этого вещества:
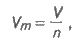 (1.6)
(1.6)
1
Точное значение (22,4 1383 ± 0,0 070) л/моль.
где
Vm -
молярный объем газа (обозначение единицы г /моль или л/моль); V - объем вещества
системы; n
- количество вещества системы. Пример записи: Vm
газа (н. у.) =22,4
л/моль.
В 1860 г. на Международном съезде
химиков в г. Карлсруэ учение Авогадро получило всеобщее признание. Съезд дал
сильный толчок развитию атомно-молекулярного учения, который стал особенно
бурным после открытия Д. И. Менделеевым периодического закона химических элементов.
На основе закона Авогадро определяют
молярные массы газированных веществ. Чем больше масса молекул газа, тем больше масса
одного и того же объема газа. В одинаковых объемах газов при одинаковых условиях
содержится одинаковое число молекул, а значит, и молей газов. Отношение масс
одинаковых объемов газов равно отношению их молярных масс:
m1: m2 = M1 : М2,
где
m1
- масса определенного объема первого газа; m2 - масса такого же объема второго
газа; М1, M2 - молярные массы соответственно первого и второго
газов.
Отношение массы определенного объема
одного газа к массе такого же объема другого газа (взятого при одинаковых
условий) называется плотностью первого газа по второму (обозначается буквой D):
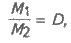 (1.7)
(1.7)
откуда
М1 = M2D.
Обычно плотность газа определяют
относительно самого легкого газа - водорода (обозначают DН2). Молярная масса водорода равна
2,016 г/моль или приближенно 2 г/моль. Поэтому будем иметь:
М = 2DH2.
(1.8)
Молекулярная масса вещества в
газуватому состоянии равна его удвоенной плотности по водороду.
Часто
плотность газа определяют относительно воздуха (Dn). Хотя воздух является смесью газов, все же
говорят о его среднюю молярну массу. Она равна 29 г/моль1. В
этом случае молярная масса определяется выражением
М = 29 Dn.
(1.9)
Определение молекулярных масс
показало, что молекулы простых газов состоят из двух атомов (Н2, F2, Сl2, Вr, N2), а молекулы благородных газов - с
одного атома (Не, Ne, Аr, Kr, Хе, Rn). Для благородных газов понятие “молекула”
и “атом” равноценны. Однако молекулы некоторых других простых веществ состоят из
трех и более атомов, например молекулы озона О3, фосфора Р4, пары серы
за невысоких температур S8.
На основе закона Авогадро осуществляют
разные расчеты - вычисление объема, массы, плотности газов при нормальных условиях,
молярной массы газированных веществ, а также относительной плотности газов (см. § 1.12).
Для решения расчетных
химических задач, связанных с газуватими веществами, часто приходится
использовать газовые законы, изучаемые в школьном курсе физики. Не
рассматривая их здесь подробно, запишем лишь формулировки и формулы, необходимые
для расчетов.
Закон Бойля - Мариотта: при постоянной
температуры объем данного количества газа обратно пропорционален давлению, под которым
он находится. Отсюда
pV = const,
(1.10)
где
р - давление; V - объем газа.
Закон Гей-Люссака: при постоянном давлении
изменение объема газа прямо пропорционально температуре, т.е.
V/T
= const,
(1.11)
где
Т - температура в кельвинах (К).
Объединенный газовый закон Бойля -
Мариотта и Гей - Люссака:
pV/Т = const.
(1.12)
Эта
формула обычно применяется для вычисления объема газа при данных условиях, если
известен его объем за других
1 Среднюю молярну массу воздуха легко
вычислить, если учесть, что воздух состоит примерно из 4 объемов азота
(молярная масса 28 г/моль) и 1 объема кислорода (молярная масса 32 г/моль), то есть 4N2 + O2. Тогда 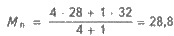 г/моль (округлены 29 г/моль).
г/моль (округлены 29 г/моль).
условий.
Если осуществляется переход от нормальных условий (или к нормальным условиям), то эту
формулу записывают так:
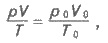 (1.13)
(1.13)
где
г0, V0, Т0
- соответственно давление, объем и температура газа при нормальных условиях (р0 =
101 325 Па, Т0 = 273 К).
Если известна масса или количество газа,
а нужно вычислить его объем, или наоборот, используют уравнение
Менделеева - Клапейрона:
pV = nRT,
(1.14)
или
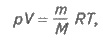 (1.15)
(1.15)
где
n - количество
вещества газа, моль; m
- масса, г; М - молярная масса газа, г/моль; R - универсальная газовая постоянная. R
= 8,31 Дж/(моль • К) .
Использование газовых законов для
решение расчетных задач по химии рассмотрены ниже.
1 Это значение используют, если
давление измеряется в паскалях, а объем - в метрах кубических, или соответственно в
кілопаскалях и литрах.
2Во время решения задач
используются округленные значения относительных атомных и молярных масс, кроме
отдельных случаев, которые указываются.