ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ОБЩАЯ
ХАРАКТЕРИСТИКА МЕТАЛЛОВ
Коррозия
металлов
Коррозией
обычно называют самопроизвольное разрушение металлов в результате их химического и
электрохимического взаимодействия с внешней средой и преобразование их в устойчивые
соединения (оксиды, гидроксиды, соли).
Собственно
говоря, коррозия представляет собой совокупность окислительно-восстановительных процессов, которые
происходящие при контакте металлов с агрессивной средой, что приводит к
разрушение металлических изделий. Под агрессивной средой имеют в виду окисную
атмосферу (присутствие кислорода в атмосфере Земли делает ее окисной), особенно в
присутствии воды или растворов электролитов.
По
механизму процесса различают химическую и электрохимическую коррозию металлов.
Химическая коррозия представляет собой обычную химическую реакцию между атомами металлов и
различных окислителей. Примерами химической коррозии является высокотемпературное окисление
металлов кислородом, окисления поверхности алюминия на воздухе, взаимодействие металлов с
хлором, серой, сероводородом H2S и др.
Электрохимическая
коррозия протекает в растворах, то есть, в основном, при контакте металлов с растворами
электролитов, особенно в тех случаях, когда металлы находятся в контакте с
менее активными металлами. Скорость коррозии существенно зависит от активности
металлов, а также от концентрации и природы примесей в воде. В чистой воде
металлы почти не подвергаются коррозии, а в контакте с более активными металлами
даже в растворах электролитов не коррозируют.
Причина коррозии
металлов
Много
металлов, включая Железо, находятся в земной коре в виде оксидов. Переход
от металла до оксида - энергетически выгодный процесс, иначе говоря, оксиды более
устойчивые соединения, чем металлы. Для того чтобы провести обратный процесс и добыть
металл из руды, необходимо затратить много энергии, поэтому железо проявляет тенденцию
превращаться снова в оксид - как говорят, железо ржавеет. Ржавление - это
термин для обозначения коррозии, то есть процесса окисления металлов под действием
окружающей среды.
Круговорот
металлов в природе можно изобразить с помощью следующей схемы:
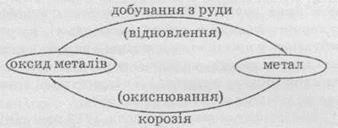
Металлические
изделия ржавеют том, что сталь, из которой они сделаны, реагирует с кислородом и
водой, которые содержатся в атмосфере. При коррозии железа или стали образуются
гидратированные формы ферум(ІІІ) оксида различного состава (Fe2О3 ∙ хН2О). Оксид проницаемый для
воздуха и воды и не образует защитного слоя на поверхности металла. Поэтому коррозия
металла продолжается и под слоем ржавчины, которая образовалась.
Когда
металлы контактируют с влажным воздухом, они всегда подлежат коррозии, однако
на скорость ржавления влияет очень много факторов. Среди них можно назвать
такие: наличие примесей в металле; присутствие кислот или других электролитов в
растворах, что соприкасаются с поверхностью железа; кислород, который содержится в этих
растворах.
Механизм электрохимической коррозии
металлической поверхности
В
большинстве случаев коррозия представляет собой электрохимический процесс. На поверхности
металла образуются электрохимические ячейки, в которых различные участки действуют как
области окисления и области восстановления.
Ниже
приведены две напівреакції окислительно-восстановительного процесса ржавления:
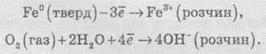
Суммарное
уравнение реакции коррозии железа можно записать так:
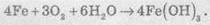
Схематично
процессы, которые происходят на поверхности железа или стали при контакте с водой,
можно представить так:
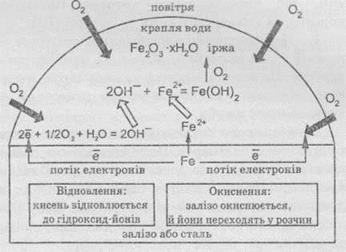
Концентрация
кислорода, растворенного в капле воды, определяет то, какие области на поверхности металла есть
местом восстановления, а какие - местом окисления.
По
краям капли, где концентрация растворенного кислорода выше, кислород восстанавливается до
гидроксид-ионов.
Необходимые
для восстановления кислорода электроны перемещаются из центра капли, где они высвобождаются
при окислении Железа и где концентрация растворенного кислорода мала. Ионы Железа переходят
в раствор. Освобождающиеся электроны по поверхности металла перемещаются к краям
капли.
Сказанное
выше объясняет, почему коррозия в наибольшей степени проявляется в центре капли воды
или под слоем краски: это области, в которые поступление кислорода ограничено. Здесь
образуются так называемые «раковины», в которых Железо переходит в раствор.
Ржавчина
как таковая возникает в результате последовательности вторичных процессов в растворе, куда
диффундируют с поверхности металла ионы Железа и гидроксид-ионы. Защитный слой на
поверхности не образуется.
Активность
протекание реакции восстановления Кислорода зависит от кислотности среды, поэтому
в кислой среде коррозия ускоряется. Любые примісні соли, например,
натрий хлорид в брызгах морской воды, способствуют образованию ржавчины, поскольку
увеличивают электропроводность воды.
Возможно,
проблему коррозии никогда не удастся решить полностью, и больше всего, на что
можно рассчитывать,- это замедлить, но не остановить.
Методы защиты
от коррозии
На
сегодня существует несколько способов предотвращения коррозии.
Отделение
металла от агрессивной среды - покраска, смазка маслами, покрытие
неактивными металлами или эмалью (И), Приведение поверхности металлов в контакт с
более активными металлами (II). Использование веществ, замедляющих коррозию
(ингибиторы коррозии), и сплавов, устойчивых к коррозии (III).
I. самый Простой способ защитить сталь от коррозии
- это изолировать металл от атмосферного воздуха. Это можно сделать с помощью
масляного, жирового смазки или нанесения защитного слоя краски.
Сейчас
широко применяют защитные покрытия из органических полимеров. Покрытие можно
делать разных цветов, и это достаточно гибкое решение проблемы коррозии. Даже
беглый взгляд на вещи, которые окружают нас в быту, дает массу примеров такого
решение: холодильник, сушилка для посуды, поднос, велосипед и т.д.
II. Иногда железо покрывают тонким слоем другого
металла. Некоторые производители изготавливают кузова автомобилей из стали с гальваническим
цинковым покрытием. При такой обработке образуется прочно сцепленный с основой слой
цинк оксида, и если гальваническое покрытие не повреждено, оно хорошо защищает от
иржи.
Даже
если такое покрытие имеет недостатки, стальной корпус машины все же защищен от
быстрого разрушения, потому что в этой системе преимущественно корродирует цинк, а не железо,
поскольку цинк более активный металл, чем железо. В данном случае цинк приносят в
жертву. Одна из самых первых предложений относительно использования протекторных
(«жертвенных») металлов была сделана в 1824 году для защиты от коррозии
металлической обшивки корпусов морских лодок.
Сегодня
цинковые блоки используют для защиты от коррозии нефтедобывающих платформ в
морях: коррозия из дорогих сложных стальных конструкций переводится на куски
металла, которые легко заменить. В чем же заключается принцип такой защиты?
Проиллюстрируем его с помощью схемы.
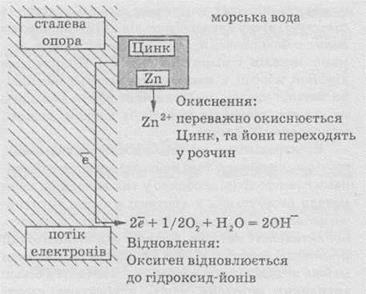
Через
определенные промежутки вдоль всей опоры, что находится в море, прикрепленные цинковые
блоки. Поскольку цинк более активен, чем железо (расположен левее в
электрохимическом ряду напряжений), то преимущественно окисляется цинк, а железная поверхность
преимущественно остается нетронутой. В принципе, любой металл, расположенный
левее железа в электрохимическом ряду напряжений, может быть использован для
защиты стальных изделий.
Аналогичный
принцип используют для защиты железобетонных конструкций жилых домов,
в которых все железные прутья соединены друг с другом и соединяются с куском магния,
зарытым в землю.
III.
Очень распространенным решением проблемы защиты от коррозии является использование іржостійких
сплавов. Многие со стальных изделий, используемых в быту, особенно те, что
находятся в постоянном контакте с водой: кухонная посуда, ложки, вилки,
ножи, бак стиральной машины и т.д. - изготовлены из нержавеющей стали, которая не
требует дополнительной защиты.
Іржостійку
сталь изобрел в 1913 году химик из Шеффилда Гарри Бріарлі. Он исследовал
быстрый износ нарезки оружейных стволов и решил попробовать сталь с
высоким содержанием хрома, чтобы посмотреть, нельзя в такой способ продолжить
жизнь оружия.
Обычно
при проведении анализа стали образец растворяли в кислоте. Бріарлі, проводя
такой анализ, столкнулся с неожиданными трудностями. Его сталь, с высоким
содержанием хрома, не растворялась. Он также заметил, что оставленные в лаборатории
образцы сохраняли первоначальный блеск. Бріарлі сразу же сообразил, что он изобрел
сталь, устойчивую к коррозии.
Изобретение
Гарри Бріарлі наткнулся на некоторые предрассудки. Один из главных производителей
металлической посуды в Шеффилде считал саму идею Бріарлі такой, «что противоречит
природе», а другой заявил, что «устойчивость к коррозии - не такое уж и большое достоинство
ножей, которые по своему назначению требуют чистки после каждого использования».
Сегодня мы воспринимаем как должное то, что посуда сохраняет свой блеск и не
подвергается воздействию кислот, содержащихся в пище.
Нержав.
сталь не поддается коррозии потому, что на ее поверхности образуется пленка
хром(III) оксида. В отличие от ржавчины, на этот оксид не действует вода, и он крепко
сцепленный с металлической поверхностью. Имея толщину всего несколько нанометров,
оксидная пленка невидимая для невооруженного глаза и не скрывает естественный блеск
металла. При этом она непроницаема для воздуха и воды и защищает металл. Больше
того, если соскоблить поверхностную пленку, она быстро восстановится.
На
сожалению, нержавеющая сталь дорога, и мы вынуждены учитывать это при выборе стали для
использование. В современной технике чаще всего используют іржостійку сталь
такого состава: 74% железа, 18% хрома, 8% никеля.
Поскольку
использование нержавеющей стали не всегда экономически оправдано, как и использование
защитных слоев смазок и красок, то сегодня довольно часто используют покрытия
железных изделий тонким слоем цинка (оцинкованное железо) или олова (луджене
железо). Последнее очень часто используют при изготовлении консервов.
Метод
защиты консервов покрытием внутренней металлической поверхности оловом предложил
англичанин Питер Дюранд. С такой защитой консервы протяжении длительного времени
остаются пригодными для еды. К сожалению, производство продуктовых консервов и
напитков не лишено трудностей. Различные продукты создают внутри банки разное
среда, которая по-разному действует на металл и может вызвать коррозию.
На
начале XX века стали выпускать баночное пиво. Однако новый продукт не имел
молниеносного успеха, и причиной этого было то, что банки кородували изнутри.
Тонкий слой олова, что им покрывали банки, очень редко выходил сплошным.
Чаще всего он имел незначительные изъяны. В водном растворе железо окисляется быстрее,
чем олово (за более высокую активность). Ионы Железа Fe2+ растворялись в пиве (которое в целом является неплохим средством от
анемии) и придавали напитку привкус металла, а кроме того, уменьшали его
прозрачность. Это снижало популярность баночного пива. Впрочем, производителям удалось
преодолеть эту проблему после того, как они стали покрывать внутренность банок
специальным инертным органическим лаком.
В
банках с консервированными фруктами являются органические кислоты, например лимонная
кислота. В растворе эти кислоты способствуют связыванию ионов Олова Sn2+ и тем самым увеличивают скорость
растворения оловянного покрытия, поэтому в консервированных фруктах (персики и т.д.)
преимущественно олово корродирует. Ионы Олова, которые попадают таким образом в пищу,
нетоксичные. Они не изменяют существенно вкусовые качества консервированных фруктов, разве
что предоставляют им островатого привкуса. Однако если такую банку хранить слишком
долго, могут возникнуть проблемы. Тонкий слой олова, который окисляется, в конце концов
разрушится под влиянием органических кислот начнет довольно быстро коррозировать
железный слой.