Температура и ее измерение
Результатом совместного решения записанных для 1 моль основного уравнения МКТ
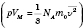
и уравнение Менделеева - Клапейрона
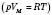
является выражение
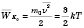
,
где
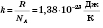
- постоянная Больцмана.
Итак:
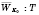
, или
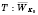
, то есть
температура - это физическая величина, которая является количественной мерой средней энергии теплового движения молекул газа.
Действие приборов для измерения температуры основан на различных физических эффектах. Наиболее распространены
жидкостные (спиртовые и ртутные) термометры, в основе действия которых лежит тепловое расширение жидкостей. Есть также термометры
газовые (термометры давления),
электрические (термометры сопротивления) и др.
Скорость молекул идеального газа
Уже отмечалось, что молекулы газов движутся хаотично, поэтому можно говорить только о
средней скорости.
Из выражения
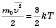
получают формулу средней квадратичной скорости молекулы
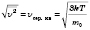
. Для удобства домножают и делят підкорінний выражение
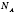
. Тогда
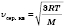
.
Ізопроцеси в газах. Абсолютная температурная шкала
Процесс в газе - это любое действие, изменяющее его состояние (нагрев, охлаждение, сжатие). При этом могут изменяться или все три параметра состояния, или два, или даже один.
Значительный интерес при анализе пове-динки газов составляют ізопроцеси.
Изопроцессами называются процессы, протекающие в системе с неизменной массой при постоянном значении одного из параметров состояния системы. Алгебраические описания изопроцесса проще всего получить, записав уравнение Клапейрона для двух состояний газа:
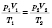
.
При применении этого уравнения по очереди для каждого ізопроцесу параметр, устойчивое в конкретном случае, сокращается.
1)
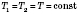
(изотермический процесс). При этом
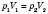
(
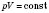
- закон Бойля - Мариотта). График этого процесса - изотерма (а).
2)
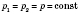
(изобарный процесс). При этом
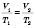
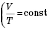
- закон Гей-Люссака). График этого процесса - ізобара (б).
3)
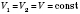
(изохорный процесс).
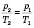
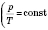
- закон Шарля). Формула Шарля в шкале Цельсия:
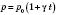
, где
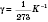
- температурный коэффициент давления. График этого процесса -
ізохора (
в).

График закона Шарля в координатах
г и
t помогает легко перейти от температуры
t до
T: если бы до самых низких температур вещество оставалась газообразной, ее давление исчезал бы при
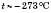
. Именно эту температуру английский физик Уильям Томсон (Кельвин) предложил рассматривать как ноль в так называемой абсолютной или термодинамической шкале температур. Следовательно:
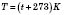
.
Насыщенная и ненасичена пара. Зависимость температуры кипения жидкости от давления
В 8 классе уже рассматривались процессы парообразования путем
испарения и
кипения, одновременно с которым происходит обратный процесс -
конденсация. Если испарение превышает конденсацию пара над жидкостью
ненасичена. При взаимном зрівноваженні этих процессов пара
насыщенная. Чем выше температура, тем большее давление насыщенного пара.
Температура кипения жидкости зале-жить от внешнего давления. Она возрастает при увеличении давления (это используется в пищевой промышленности и медицине для создания автоклавов). При снижении давления температура кипения снижается (высоко в горах кипяток оказывается «прохолодкуватим», а яйцо не удается сварить вкрутую).