ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ХИМИЯ ЭЛЕМЕНТОВ
ОКСИГЕН. СУЛЬФУР
Сероводород
Молекула
сероводорода состоит из атома Серы и двух атомов Водорода, соединенных полярным
ковалентной связью. Угол между связями SH равна 91°. Молекула сероводорода
полярная.
Сероводород
- природный компонент вулканических и природных газов. Некоторые минеральные воды
содержащие растворенный сероводород, что придает им лечебных свойств.
Сероводород образуется в результате гниения продуктов, содержащих в своем
составе белки. В Черном море на глубине более 40 метров нет жизни через
насыщенность вод сероводородом.
Физические свойства сероводорода
Сероводород
- бесцветный газ с запахом тухлых яиц. В 1 объеме воды растворяется 3 объема
сероводорода, при этом образуется примерно 0,1 молярный раствор. Температура
плавления сероводорода равна -83 °С, а температура кипения -61 °С. Сероводород
влияет на нервную систему человека, поэтому работать с ним необходимо под вытяжной
шкафом.
Химические свойства сероводорода
Сероводород
является соединением, имеет строение, подобное молекулы воды, однако по сравнению с ней есть
менее стабильной. В случае нагрева до высоких температур происходит разложение
сероводорода по реакции:
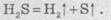
Горения
может происходить по двум различным направлениям. В избытке кислорода образуется вода
и сульфур(ИV)
оксид:
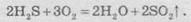
По
недостатке кислорода происходит неполное сгорание сероводорода. Этот процесс
используется для добывания серы в промышленных масштабах из газов, которые
образуются во время обжига руд:
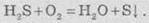
Бром
и йод восстанавливают сероводород до простого вещества серы:
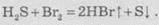
Сероводород
при повышенных температурах реагирует с гексафторсульфуром:
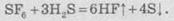
В
случае растворения сероводорода в воде образуется слабая двохосновна сульфидная
кислота (Кa1 = 10-7, Кa2 = 1,2 ∙ 10-13):
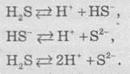
Средние
соли сульфидной кислоты называются сульфидами (например, K2S - это калий сульфид). Известны также кислые
соли соответствующей кислоты - гідрогенсульфіди (KHS - калий гідрогенсульфід). Поскольку
сульфидная кислота является довольно слабой кислотой, то растворы сульфидов и
гідрогенсульфідів подвергаются гидролизу по аниону, и соответственно среда
раствора основное:
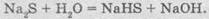
Сульфиды
щелочных и щелочноземельных металлов растворимы в воде, а другие сульфиды не растворимы.
Много солей сульфидной кислоты имеют характерную окраску: HgS - красное, Sb2S3 -
оранжевое, CdS -
желтое, MnS -
розовое, CuS -
черное.
Добывания и применения сероводорода
Сероводород
обычно добывают действием минеральных кислот на сульфиды металлов:
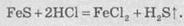
Сероводород
также можно добыть и из простых веществ.
Применяют
сероводород в качественном анализе катионов по сульфідною классификации. Также он
играет важную роль в процессе производства серной кислоты.
Качественная
реакция на сероводород i
сульфид-ион
Для
определение сульфид-ионов в растворе к исследуемому раствору добавляют любую
растворимую соль Свинца (чаще всего ацетат Рb(СН3СОО)2 или
нитрат Pb(NO3)2). Если после добавление в растворе
появляется черный осадок, то в исследуемом образце присутствовали сульфид-ионы: