РАЗДЕЛ II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
9. Неметаллические элементы и их соединения. Неметаллы
9.3. Элементы VIA группы
9.3.7. Сероводород (сульфид водорода). Сероводородная (сульфидная) кислота. Сульфиды2
Сероводород и сероводородная кислота Сероводород или сульфид водорода H2S,- летучее соединение Серы с Гідрогеном. В молекуле сероводорода атом Серы образует две ковалентные полярные связи с двумя атомами Водорода. Валентный угол составляет 92,1°. Раствор H2S в воде называют сероводородной кислотой.
Распространенность сероводорода в природе
В природе сероводород встречается в составе природных и вулканических газов, содержится в воде некоторых минеральных источников, также образуется при разложении органических веществ (растительных и животных остатков), а потому в небольшом количестве содержится в воздухе.
Огромные запасы сероводорода накопленные в глубинах Черного моря: его слой начинается с глубины 150-200 м и достигает дна (максимальная глубина - 2210 м). Концентрация сероводорода на глубине 150 м - 0,19 мг/л морской воды, на глубине 200 м - 0,83 мг/л, а на глубине 2000 м достигает 9,60 мг/л. Таким образом, за исключением некоторых специфических микроорганизмов, там почти нет живых существ.
Физические свойства и физиологическое действие сероводорода
Сероводород - бесцветный газ с резким неприятным запахом тухлых яиц - вич воды растворяется до 2,5 л H2S. Сероводород очень ядовит. Наличие в воздухе объемной доли 0,1 % вызывает отравление. Гидроген сульфид связывает гемоглобин, образуя с ионом Fe2+, входящей в его состав, малорозчинну соединение - феррум(II) сульфид.
Добыча сероводорода
В лаборатории для извлечения сероводорода используют реакцию между сульфидом металлического элемента и хлоридной кислотой или разбавленной серной кислотой:
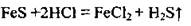
В промышленности сероводород добывают, пропуская водород над расплавленной серой:
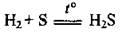
Химические свойства сероводорода и сульфидной кислоты
Сероводород
1. Сероводород горит голубоватым пламенем:
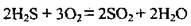
При недостатке кислорода образуется сера:
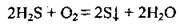
2. Сероводород относят к сильным восстановителям - он может окисляться до серы, сульфур(ИV) оксида или серной кислоты:
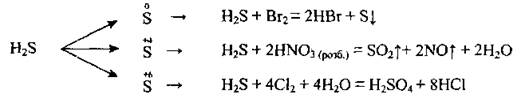
3. Сульфид водорода взаимодействует с кислотами-окислителями:
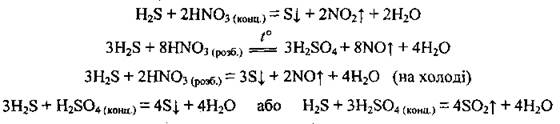
4. Реагирует и с сильными, и со слабыми окислителями:
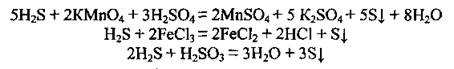
Использование сероводорода
1. В химической промышленности для получения серной кислоты, элементарной серы, сульфидов.
2. В органическом синтезе серосодержащих веществ (тиолов3).
3. Как реагент в аналитической химии для обнаружения ионов тяжелых металлических элементов (Ag+, Pb2+, Сu2+).
4. В перспективе возможно использование гигантских запасов сероводорода, которые содержатся в Черном море для нужд сероводородной энергетики и химической промышленности.
5. В медицине природные источники и искусственные ванны, содержащие сероводород, используют для борьбы с кожными заболеваниями.
Сульфидная кислота
Раствор сероводорода в воде - сероводородная вода, или сероводородная (сульфидная) кислота - слабая двохосновна кислота. Она слабее сульфітну кислоту H2SO3. Диссоциирует двоступенево (за II степенью - в незначительной степени):
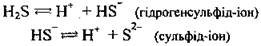
Сульфидная кислота проявляет общие свойства кислот. Она реагирует с основными оксидами, основаниями, образуя средние и кислые соли, а также с некоторыми солями и металлами:
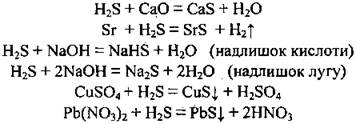
Соли сероводородной кислоты
Сероводородная кислота образует два ряда солей: средние - сульфиды (K2S, CaS) - и кислые - гідроґенсульфіди (KHS, Ca(HS)2). Растворимыми в воде сульфиды щелочных и щелочноземельных металлических элементов, а также аммоний сульфид (NH4)2S. Некоторые сульфиды имеют характерную окраску: черное - PbS и CuS, желтое - CdS, белое - ZnS, MgS, розовое - MnS.
Химические свойства сульфидов
1. Растворимые в воде сульфиды медленно гидролизуют, то есть разлагаются водой:
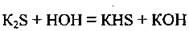
В результате полного гидролиза в растворе некоторые сульфиды получить невозможно:
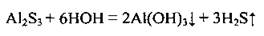
2. Сульфиды реагируют с некоторыми другими солями:
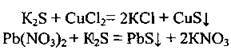
Эти две реакции являются качественными на обнаружение сульфид-иона S2-, ведь наблюдается образование характерных осадков черного цвета - CuS и PbS.
3. Сульфиды разлагаются сильными кислотами:
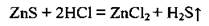
4. Сульфиды при взаимодействии с окислителями проявляют восстановительные свойства:
______________________________________________________________
1 Реакцию используют для связывания разлитой ртути (демеркуризация). Участок пола, где разбился ртутный термометр, необходимо посыпать порошком серы. Киноварь - неядовитая соединение. Она не испаряется (при комнатной температуре) и легко может быть собрана.
2 Полисульфиды - соединения Серы с общей формулой X2Sn, структура которых содержит цепочки атомов -S-S(n-2)-S-, где, в зависимости от компонента X, n может варьироваться: в полісульфідах ВодородаH2Sn (оліїсті жидкости в зависимости от содержания Серы от желтого до красного цвета) п изменяется от 2 до 23, в полісульфідах аммония (NH4)2Sn - от 2 до 9, щелочных металлов Me2Sn - от 2 до 8. Их используют в кожевенной промышленности для удаления волос с кожи), в производстве красителей, полисульфидных каучуков, в аналитической химии.
3 Тіоли (или меркаптаны) имеют сильный неприятный запах. В частности, егантіол C2H5SH добавляют к природному газу (метану запаха нет) перед его подачей в бытовой газопровод, чтобы обнаружить утечки газа из системы.