ХИМИЯ МЕТАЛЛИЧЕСКИХ ЭЛЕМЕНТОВ
КАЛЬЦИЙ
Одна из важнейших соединений кальция
- оксид СаО (негашеная известь). Его получают разложением известняка (состоящего,
в основном, из карбоната кальция) при высокой (около 1000 °С) температуре:
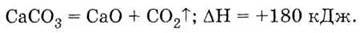
Это - оксид лужноземельного металла,
поэтому он легко взаимодействует с водой, образуя щелочь - гидроксид кальция:
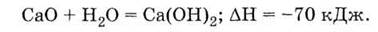
Техническое название Са(ОН)2 - гашеная
известь (реакция его получения в технике называется «гашением извести»). Водный
раствор гидроксида кальция - известковая вода - является раствором щелочи.
С солями кальция (а также магния,
железа и некоторых других многовалентных металлов) - гідрокарбонатами, сульфатами,
хлоридами - связано такое распространенное явление, как жесткость воды. Во время
кипячение (или впаривание) водного раствора гидрокарбонатов последние
разлагаются с образованием карбонатов, которые выпадают в осадок и образуют накипь,
например:
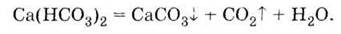
В виде накипи оседают не только
карбонаты, но и другие соли, особенно малорастворимые сульфаты, которые содержатся в
воде, поэтому перед использованием ее смягчают, т.е. удаляют из нее соли
кальция, магния и др. Несколько смягчить воду можно при помощи бытовых
фильтров для питьевой воды; отфильтрованная вода дает меньший накипь, что очень важно
при использовании электрического чайника.
Удалить накипь можно, обработав осадок
карбонатов кислотой (например, уксусной).
В таблице представлены основные химические
свойства кальция и его соединений.
Таблица
Кальций и его соединения
|
Кальций
|
Соединения Кальция
|
|
оксид и гидроксид кальция
|
соли кальция
|
|
1. Серебристо-белый
металл
2. Активный металл, окисляется простыми веществами:
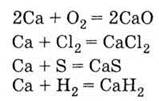
3. Вытесняет
водород из воды:
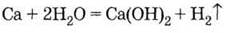
4. Вытесняет
металлы из их оксидов (кальцієтермія):
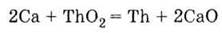
Получение
Разложение
электрическим током расплава хлорида кальция:
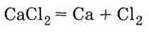
|
1. Порошки белого цвета
2. Оксид кальция (негашеная известь) проявляет свойства
основного оксида:
взаимодействует
с водой с образованием основания
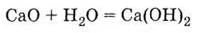
взаимодействует
с кислотными оксидами
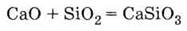
3. Гидроксид кальция проявляет свойства сильной
основы:
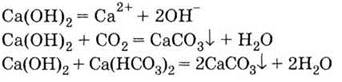
Получение
1. Оксида - обжигом известняка:
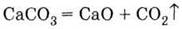
2. Гидроксида - гашением негашеной извести:
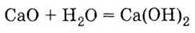
|
1. Нерастворимый карбонат:
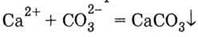
и
растворимый гидрокарбонат:
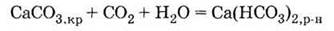
2. Нерастворимый фосфат:
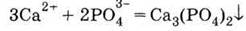
и
растворимый дигидрофосфат:
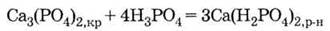
3. Гидрокарбонат
разлагается при кипячении или выпаривании раствора:
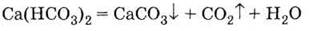
4. Обожженный природный гипс
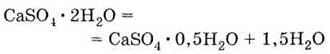
затвердевает при
взаимодействии с водой, снова образуя кристаллогидрат:
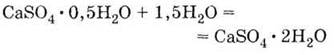
|