Часть 3 ЭЛЕКТРИЧЕСТВО И МАГНЕТИЗМ
Раздел 8 ЭЛЕКТРИЧЕСТВО
8.10. Электропроводность электролитов. Законы Фарадея
Электролиты - растворы солей, кислот,
щелочей в жидкостях - являются хорошими проводниками электрического тока. Ток в
электролитах сопровождается электролизом - выделением на электродах, погруженных
в раствор, составных частей электролита. В отличие от металлов, которым свойственна
электронная проводимость, ток в электролитах обусловлен напрямленим движением ионов.
Ионы возникают в результате взаимодействия молекул растворенного вещества с молекулами
растворителя. Процесс расщепления молекул растворимого вещества на ионы называют
електролітичною диссоциацией. Положительные ионы движутся к катоду, называют
катионами, а отрицательные ионы движутся к аноду, - анионами (рис. 8.6).
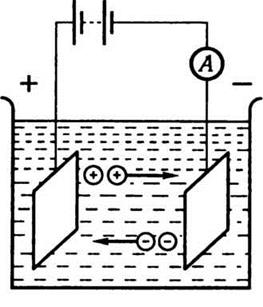
Рис. 8.6
Если в электролит погрузить два
электроды и создать между ними разность потенциалов, то возникнет упорядоченное движение
ионов или сольватів (сольват состоит из иона и сольватної оболочки,
содержит несколько слоев молекул растворителя).
Пусть в единице объема содержится n+ положительных и n- отрицательных носителей электрического
заряда. Абсолютное значение носителей зарядов равна соответственно q+ и q-.
Если под действием поля носители приобретают скоростей υ+ и υ-, то за единицу времени через единичную
плоскость пройдет n+υ+ положительных носителей, которые перенесут
заряд q+n+υ+. Аналогично отрицательные носители
переносить заряд q-n-υ-. Следовательно, плотность тока
будет определяться по формуле:
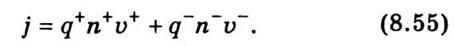
Из закона сохранения электрического
заряда (условие электронейтральности раствора электролита) вытекает равенство
суммарных положительных и отрицательных зарядов:
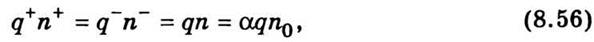
где
n - количество диссоциированных молекул
для одно-одновалентных солей; n0 - концентрация молекул растворенного
вещества; α - коэффициент диссоциации,
равен отношению концентрации ионов одного знака к концентрации молекул
растворенного вещества. Тогда плотность тока

Скорость упорядоченного движения ионов
(сольватів) можно найти из следующих соображений. На отдельный ион действует сила со стороны
электрического поля 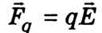 и сила трения Стокса
и сила трения Стокса 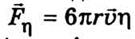 (r - радиус иона; и - скорость движения иона;
(r - радиус иона; и - скорость движения иона;
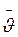 -
коэффициент вязкости жидкости).
-
коэффициент вязкости жидкости).
Ион будет двигаться равномерно, если
сила 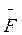 η равна силе
η равна силе 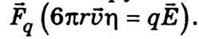 Отсюда
получим выражение для скорости иона
Отсюда
получим выражение для скорости иона

а
для его подвижности

Из формул (8.57) и (8.59) следует,
что для электролитов закон Ома имеет такой вид:

где
σ - электропроводность электролита,
что равняется

Электропроводность электролитов
значительно меньше, чем электропроводность металлов. С повышением температуры
электропроводность электролитов быстро растет, что обусловлено увеличением
степени диссоциации раствора и уменьшением вязкости электролита.
Основные законы электролиза
экспериментально установил М. Фарадей в 1834 г.
Первый закон Фарадея: масса вещества,
которая выделяется на электроде, прямо пропорциональна количеству электричества q, прошедшего через электролит:

где
И - сила тока; t - время прохождения тока.
Коэффициент пропорциональности k, который численно равен массе
вещества, выделяющегося на электроде при прохождении через электролит единицы
количества электричества, называется электрохимическим эквивалентом вещества.
Второй закон Фарадея: электрохимические
эквиваленты элементов прямо пропорциональны их химическим еквівалентам. Химическим
эквивалентом элемента называют отношение его атомной массы к валентности
Z. Поэтому

Согласно второму закону Фарадея
коэффициент с является универсальной постоянной для всех
элементов. Конечно вместо постоянной с пользуются обращенной к ней величине F = 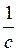 , которую называют числом Фарадея.
, которую называют числом Фарадея.
Следовательно,

Подставим это выражение в (8.62) и
получим формулу, объединяющую оба закона Фарадея:
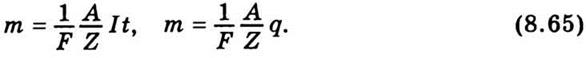
Отсюда нетрудно выяснить физический
смысл постоянной Фарадея. Действительно, если при электролизе выделяется m / А = 1 / Z молей вещества, то
заряд, прошедший через электролит, численно равна F. Опыт показывает, что F = 96485,309 Кл/моль.
Прохождение тока через электролиты
неразрывно связано с перемещением вещества. Отсюда следует, что в
электролитах, в отличие от металлических проводников (проводников первого рода),
носителями тока являются не свободные электроны, а ионы - заряженные частицы вещества.
Ионы - это атомы или группы атомов, которые имеют избыток или недостаток электронов
по сравнению с нейтральными атомами и молекулами.
Из законов Фарадея следует, что
любой электрический заряд состоит из целого числа элементарных зарядов -
«атомов электричества». На это впервые обратил внимание Г. Гельмгольц в 1881 г. в речи,
посвященной памяти Фарадея, где он подчеркнул, что, принимая существование атомов
химических элементов, нельзя избежать дальнейшего выводу о атомність
электричества. Действительно, для выделения на электроде одного моля одновалентної
вещества нужно, чтобы через электролит прошло количество электричества, которое
равно числу Фарадея F. Если вещество имеет валентность Z,
то для выделения на электроде одного моля нужное количество электричества,
равно ZF. Поскольку при этом переносится то же число NА
частиц (ионов) вещества (число Авогадро), то на отдельную частицу Z-валентной вещества приходится заряд

а
в случае одновалентної вещества

Отсюда можно сделать два вывода:
1) заряды Z-валентных ионов разные, но среднее значение их равно 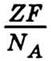 (подобно
до того, как молекулы газа имеют разную кинетическую
энергию поступательного движения, а
среднее значение ее
равен
(подобно
до того, как молекулы газа имеют разную кинетическую
энергию поступательного движения, а
среднее значение ее
равен 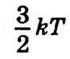 ; 2) каждый iон
имеет определенный заряд
; 2) каждый iон
имеет определенный заряд 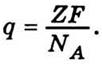 Причем заряды ионов могут
отличаться лишь на значения, кратные элементарному
заряда, равную заряду одновалентного иона
Причем заряды ионов могут
отличаться лишь на значения, кратные элементарному
заряда, равную заряду одновалентного иона 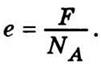 Второй вывод эквивалентен
предположению об атомной («зернистую») строение всех электрических зарядов. Опыты
подтвердили справедливость такого вывода.
Второй вывод эквивалентен
предположению об атомной («зернистую») строение всех электрических зарядов. Опыты
подтвердили справедливость такого вывода.