РАЗДЕЛ II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
7. Основные классы неорганических соединений
7.1. Оксиды
Оксиды - это бинарные соединения элементов с Оксигеном, в которых он проявляет степень окисления -2. Характерные Признаки оксидов:
• степень окисления Кислорода - -2;
• атомы Кислорода не связаны между собой, а соединяются только с атомами других элементов;
• атомы элемента, образующего оксид, имеют одинаковую степень окисления1.
Графические формулы оксидов
|
Валентность элементов
|
Графическая формула
|
|
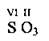
|
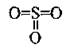
|
|
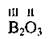
|
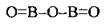
|
|
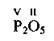
|
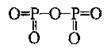
|
Не все бинарные соединения Кислорода являются оксидами:
|
Вещество
|
Формула
|
Графическая формула
|
Степень окисления Кислорода
|
|
гидроген пероксид
|
H2O2
|
H-O-O-H
|
-1
|
|
натрий пероксид
|
Na2O2
|
Na-O-O-Na
|
-1
|
|
оксиген флуорид
|
OF2
|
F-O-F
|
+2
|
По химическому характеру оксиды разделяют на несолетворні и солетворні.
Несолетворні оксиды - NO, N2O, CO, SiO - это оксиды, которые относят к реакционно способных соединений, но во время реакций соли не образуются. Они не реагируют с водой, кислотами и основаниями при обычных условиях (следовательно, к классу оксидов их относят условно).
Солетворні оксиды - это оксиды, которые образуют соли. Солетворні оксиды подразделяют на основные (К2O, ВаО, MgO, FeO), кислотные (SO2, SO3, N2O5, P2O5) и амфотерные (ZnO, Аl2O3, Cr2O3, BeO).
Номенклатура оксидов
Название оксидов состоит из названия элемента, после которой, когда элемент проявляет несколько степеней окисления, в скобках римскими цифрами указывают степень его окисления и добавляют слово «оксид». Например:
• К2O - калий оксид;
• Fe2O3 - феррум(ІІІ) оксид;
• Сu2O - купрум(И) оксид;
• MgO - магний оксид;
• Р2O5 - фосфор(V) оксид;
• Аl2O3 - алюминий оксид;
• СО - карбон(II) оксид.
Некоторые, давно известны человеку оксиды имеют и тривиальные названия: СаО - негашеная известь, СO2 - углекислый газ, SO2 - сернистый газ.
Получения оксидов
1. Взаимодействие простых веществ (металлов и неметаллов) с кислородом:
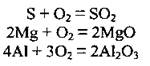
2. Окисление сложных веществ:
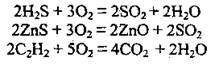
3. Термическое разложение:
• основ:
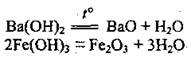
• солей:
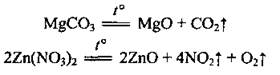
• амфотерных гидроксидов:
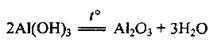
• некоторых кислот:
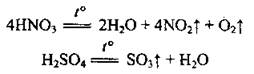
4. Во время некоторых других реакций:
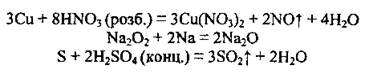
______________________________________________________
1 Двойной «оксид» (FeFe2)O4 содержит Ферум с различными степенями окисления (+2 и +3) и при взаимодействии с кислотными оксидами образует две различные соли.
7.1.1. Основные оксиды
Основные оксиды - это оксиды, гидраты которых являются основаниями. Все основные оксиды являются оксидами металлических элементов, которые обнаруживают невысокие степени окисления (+1, +2). До основных оксидов относятся:
• окислы металлических элементов главных подгрупп i И II групп (кроме Be);
• оксиды одновалентных элементов, двухвалентных, за исключением BeO, ZnO, ГbО, которые являются амфотерными;
• оксиды переходных металлических элементов в низких степенях окисления (NiO, FeO, МnО, СrO).
Основным оксидам соответствуют основания:
Na2O - NaOH
MgO - Mg(OH)2
FeO - Fe(OH)2
BaO - Ba(OH)2
CrO - Cr(OH)2
Тип химической связи в основных оксидах преимущественно ионный.
Химические свойства основных оксидов
1. Взаимодействие с кислотами с образованием солей:
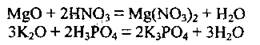
2. Взаимодействие с кислотными оксидами с образованием солей:
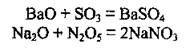
3. Взаимодействие с водой. Только оксиды щелочных и щелочноземельных металлических элементов взаимодействуют с водой, образуя щелочи:
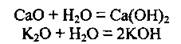
4. Взаимодействие с амфотерными оксидами. Реакция происходит во время сплавления. Амфотерный оксид в этой реакции проявляет кислотные свойства:
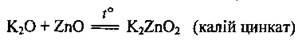
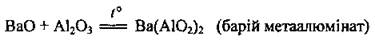
5. Взаимодействие с амфотерными основаниями. Реакция происходит во время сплавления: