ЧАСТЬ И
ОБЩАЯ ХИМИЯ
РАСТВОРЫ
Растворимость.
Кристаллогидраты
Растворимость
- это свойство вещества растворяться в воде или в каком-либо другом растворителе.
По
растворимостью вещества делятся на растворимые, малорастворимые и нерастворимые. Однако
следует отметить, что абсолютно нерастворимых веществ не существует. Любое вещество,
даже такая как стекло или золото, в очень малых количествах растворяется в воде.
Есть
вещества, которые неограниченно смешиваются друг с другом, например, этиловый спирт и
ацетон неограниченно растворяются в воде. Из них можно приготовить растворы с
любой концентрацией. Однако для большинства веществ существует определенная граница
растворимости. У некоторых эта граница большая, например, сахар, соль, медный купорос -
хорошо растворимые вещества. В других растворимость намного меньше - гипс, свинец
сульфат, бензен - это малорастворимые вещества. А некоторые вещества имеют вообще
незначительную растворимость - растительное масло, серебро, керосин, стекло, инертные газы - это
практически нерастворимые вещества.
В
почему же причина существования предела растворимости? Если в контакте находятся вода и
кристаллы какого-либо растворимого вещества, то наряду с процессом растворения
происходит обратный процесс - кристаллизация. От самого начала, когда
концентрация вещества небольшая, растворение происходит достаточно быстро, а
кристаллизация - медленно. По мере увеличения концентрации вещества в растворе
скорость растворения замедляется, а скорость кристаллизации ускоряется, и
в определенный момент времени скорости этих двух процессов становится одинаковой. Возникает
равновесие между кристаллами вещества и раствором.
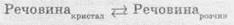
Когда
концентрация этого вещества в растворе уже увеличиваться не может, то раствор становится
насыщенным.
Насыщенным
называют раствор, находящийся в динамическом равновесии с избытком растворенного
вещества.
Чтобы
приготовить насыщенный раствор, надо добавлять вещество в воду при определенной температуре,
перемешивая ее до тех пор, пока она перестанет растворяться, то есть избыток вещества
останется нерозчиненим. В этом случае между раствором и избытком вещества возникает
динамическое равновесие: сколько частиц вещества переходит в раствор, столько же и
выкристаллизовывается. В насыщенном растворе при определенной температуре содержится
максимально возможное количество растворенного вещества.
Соответственно,
если концентрация вещества меньше предел ее растворимости, то такие растворы
называют ненасыщенными, а если большая - пересыщенными. Пересыщенные растворы очень
неустойчивые. Пересыщенные растворы могут образовываться, если насыщенный раствор
осторожно охлаждать. При этом растворимость вещества уменьшается и избыток ее
должно выпасть в виде осадка. Однако при отсутствии центров кристаллизации осадок не
образуется и, соответственно, раствор становится пересыщенным. Легкое встряхивание сосуда
или введение в раствор кристаллика вещества (центра кристаллизации) влечет
выпадение в осадок избытка растворенного вещества. Пересыщенные растворы могут
образовывать сахароза, глауберова соль, натрий ацетат, бурая.
Количественно
растворимость выражают составом насыщенного раствора. Чаще всего для количественного
описания растворимости используют так называемый коэффициент растворимости (или просто
растворимость) - массу вещества, которая способна раствориться в 100 г воды по определенной
температуры. Например, растворимость купрум(ІІ) сульфата при +20 °С равна 20,7 г. Это означает, что в 100 г воды при этой
температуре может раствориться не более 20,7 г купрум(II) сульфата. Избыточная относительно
этого количества вещество не растворится и останется в виде осадка. Некоторые вещества
(такие как сульфатная кислота, этиловый спирт и т.д.) могут неограниченно растворяться
в воде. Однако таких веществ не так уж и много (по сравнению с числом веществ,
которые могут растворяться в воде). Растворимость многих веществ в воде установлена
и возведена в специальные таблицы. Упрощенной подобной таблицей является таблица
растворимости кислот, солей и оснований.
Чем
можно объяснить различную растворимость веществ в воде? Для этого необходимо рассмотреть
причину растворения. Молекула воды представляет собой диполь, то есть частицу, на разных
концах которой имеются разноименные заряды. Благодаря этому молекулы воды могут
взаимодействовать с частицами ионных кристаллов (ионами) или полярными молекулами.
На основании этого логично предположить, что вещества с неполярными молекулами
почти не растворяются в воде, что мы и наблюдаем: сахароза (полярная
вещество хорошо растворяется в воде, сера или бензен (неполярные вещества)
почти не растворяются в воде.
Но
если воду рассматривать как полярный растворитель, то возникает справедливое утверждение,
что существуют также и неполярные растворители. В принципе, любую жидкость можно
рассматривать как растворитель.
Все
растворители можно классифицировать как полярные, малополярні и неполярные. Эта характеристика
растворителей во многом определяется молекулой растворителя. В полярных
растворителям относятся вода, спирты, ацетон, глицерин и др. В неполярных:
бензен, гексан, октан и др. В малополярных растворителей можно отнести эстеры
органических кислот. Такие вещества применяются как клей для пластмассовых изделий
(бутилацетат), пищевая эссенция с запахом дюшеса (ізоамілацетат) и т.п.
Еще
в алхимический период становления химии был открыт один из главных принципов,
которым определяется растворимость веществ: подобное растворяется в подобном.
Исходя
из этого принципа, можно объяснить, почему некоторые вещества растворяются в одном
растворителе и не растворяются в другом. Веществ, которые растворялись бы совершенно в
всех растворителях - не существует. Так, полярные вещества хорошо растворяются в
полярных растворителях, хуже растворяются в малополярных и практически не
растворяются в неполярных. Например, сахар хорошо растворяется в воде и вообще
не растворяется в бензені. И наоборот, неполярные вещества растворяются в
неполярных растворителях и плохо - в полярных. Например, сера не растворяется
(и даже не смачивается) в воде и хорошо растворяется в бензені.
Кристаллогидраты
Очень
часто при кристаллизации некоторые вещества не успевают (или им это энергетически
невыгодно) избавляться от своей оболочки из молекул воды и кристаллизуются вместе с
водой. Такие вещества называют кристалогідратами. Существование кристаллогидратов есть
одним из доказательств существования процесса сольватации. Например, при растворении белого
порошка купрум(II) сульфата в воде образуется раствор синего цвета. Такого
цвета растворы оказывают гидратированные ионы Купруму Сu2+. При
выпаривании этого раствора в осадок выпадают кристаллы синего цвета, в состав
которых входит вода. Воду, которая входит в состав кристаллов, называют кристалізаційною.
Кристаллические
вещества, в состав которых входит определенное число молекул кристаллизационной воды,
называют кристалогідратами.
Однако
следует отметить, что, в отличие от растворов, в кристалогідратах каждую частичку
вещества окружает только определенная, свойственная этому веществу, количество молекул воды. В
связи с этим
состав таких веществ можно однозначно установить и записать химической формулой.
Так, кристаллогидрат купрум(ІІ) сульфата имеет состав CuSO4 ∙
5Н2O.
Много
кристаллогидратов имеют собственные назвы. Например,
п'ятиводний купрум(ІІ) сульфат CuSO4 ∙ 5H2O называют
медным купоросом, десятиводний натрий сульфат Na2SO4 ∙ 10H2O -
глауберовой солью, семиводний ферум(ІІ) сульфат FeSO4 ∙ 7H2O - железным купоросом, двохводний
кальций сульфат CaSO4 ∙ 2H2O -
гипсом и т.д.
Зависимость
растворимости веществ от их природы, температуры и давления
Как
и любой физико-химический процесс, процесс растворения подчиняется определенным
закономерностям. Выше мы уже рассматривали влияние температуры и давления на скорость
химических процессов. Аналогично можно предположить, что эти параметры так же
влияющие на растворимость веществ.
Так,
растворимость твердых и жидких веществ с повышением температуры увеличивается, а
с понижением - уменьшается. Для газированных веществ характерна обратная
зависимость: с повышением температуры их растворимость уменьшается, а со
понижением - увеличивается.
На
растворимость веществ также влияет и внешнее давление. Поскольку при растворении
твердых и жидких веществ общий объем существенно не меняется, то изменение давления
на растворимость таких веществ почти не влияет. А при растворении газов общий
объем меняется существенно, вследствие чего при повышении давления растворимость газов
увеличивается, а при снижении - уменьшается.
Взаимный
воздействие растворяющих веществ
Если
в воде уже растворено какое-либо вещество, то в этом растворе газы растворяются
хуже, чем в чистой воде. Наибольшее влияние на растворимость газов в воде
оказывают растворенные электролиты. Так, растворимость кислорода в воде в присутствии
натрий хлорида значительно меньше, чем в чистой воде, причем растворимость существенно
уменьшается с повышением концентрации соли. Сегодня это явление называют
законом Сеченова.
Уменьшение
растворимости в присутствии других веществ характерно не только для газов. Например,
если до насыщенного раствора калия хлорида добавить небольшое количество натрий
хлорида, то растворимость калий хлорида уменьшается и часть вещества выпадает в
осадок. Это явление называют висолюванням.
Снижение
растворимости веществ в растворах электролитов обусловлено гидратацией ионов,
вызывает уменьшение концентрации свободных молекул воды. Часть молекул воды,
которая уже связана с ионами электролита, не может вступать в процесс сольватации
других частиц и, соответственно, не является растворителем для других веществ.