ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ОРГАНИЧЕСКАЯ
ХИМИЯ
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ. АЛКАНЫ
Физические
свойства алканов
Много
физических свойств (температура плавления и кипения) гомологов меняются не
линейно, а «пилкоподібною» зависимости от количества атомов Углерода, которую мы
подаем в виде графика:
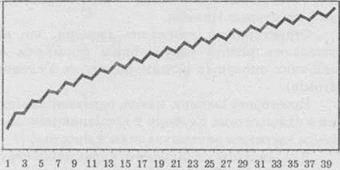
При
нормальных условиях (0 °С, 1 атм) первые четыре гомологи представляют собой газы; соединения,
содержит от 5 до 15 атомов Углерода - жидкости; высшие углеводороды - твердые
вещества. При одинаковом числе атомов Углерода молекулы алканов с разветвленной
строением имеют более низкие температуры кипения, чем нормальные алканы.
Все
алканы представляют собой бесцветные или белые вещества. Летучие углеводороды имеют
характерный «бензиновый» запах. Высшие углеводороды представляют собой жирные на ощупь
мягкие вещества, их типичный представитель - парафин, из которого изготавливают
свечи.
Алканы
практически не растворимые в воде, потому что их молекулы малополярні и не
взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических
растворителях, таких как тетрахлорметан и др. Жидкие алканы легко смешиваются друг с
одним.
Химические свойства алканов
По
обычных условиях алканы химически инертны .они устойчивы к действию многих реагентов:
не взаимодействуют с концентрированными серной и нітратною кислотами,
концентрированными и расплавленными щелочами, не окисляются сильными окислителями -
калий перманганатом КМnO4
т.д.
Химическая
устойчивость алканов объясняется высокой прочностью связей С-С и С - Н, а также их
неполярністю. Неполярные связи С-С в алканах не подвержены ионного разрыва,
но способны к расщеплению гемолитико под действием активных свободных радикалов. Для
алканов характерны радикальные реакции, в результате которых получаются соединения, где
атомы Водорода замещены на другие атомы или группы атомов. Итак, алканы вступают
в реакции, протекающие по механизму радикального замещения. За таким
механизмом легче всего замещаются атомы Водорода у третичных, затем у вторичных
и первичных атомов Углерода.
1. Галогенування. При взаимодействии алканов с галогенами
(хлором и бромом) под действием ультрафиолетового излучения или высокой
температуры образуется смесь продуктов моно - к полігалогензаміщених
алканов. Общая схема этой реакции показана на примере метана:
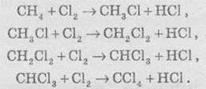
2.
Нитрования (реакция Коновалова). Во время действия азотной кислоты на алканы при
температуре +140 °С и небольшом давлении протекает радикальная реакция:
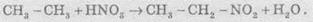
3.
Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с
разветвленной цепью:

4. Крекинг - это гомолітичний разрыв связей С-С,
протекающий при нагревании и под действием катализаторов. При крекинге алканов
образуются алкены и низшие алканы, при крекинге метана и этана образуется
ацетилен:
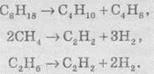
Эти
реакции имеют большое промышленное значение. Таким путем высококипящие фракции
нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
5. Окисления. При мягком окислении метана кислородом
воздуха в присутствии различных катализаторов могут быть получены метиловый
спирт, формальдегид, муравьиная кислота:
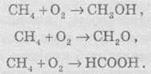
Мягкое
каталитическое окисление бутана кислородом воздуха - один из промышленных способов
извлечения уксусной кислоты:
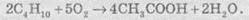
На
воздухе алканы сгорают до СO2
и Н2O:
