РАЗДЕЛ II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
9. Неметаллические элементы и их соединения. Неметаллы
9.1. Водород
9.1.2. Вода
Мировой океан покрывает около 71 % земной поверхности. Масса гидросферы - 1,39 · 1018 т - составляет 0,05 % массы планеты (но это в десять раз меньше, чем содержится в мантии Земли). Много воды - 1,4 · 1013 т - содержится и в атмосфере нашей планеты1. Масса ледников Арктики, Антарктиды и высокогорных районов других материков - 2,4 · 1016 т (85 % пресной воды); примерно столько же воды находится под землей (далеко не вся она пригодна для нытья). Количество пресной воды рек, озер, болот, водохранилищ, пригодной для использования человеком, составляет всего 2 · 1014 т.
Много воды в космосе - второе место по распространенности после водорода. Входит в состав многих космических тел: это основа (более 50 %) ядер комет2, много ее на спутниках Юпитера - Калисто (до 55 % массы), Ганимеде (до 50 % массы) и Европе (которая также покрыта слоем воды толщиной предположительно 110-130 км), Сатурна - Энцеладе, Тефії. Согласно последних исследований3 много водяного льда есть и на Луне.
Это единственное в мире вещество, которое в естественных условиях одновременно могут существовать в трех агрегатных состояниях - твердом (лед), жидком (собственно вода) и газообразном (водяной пар).
Аномальные свойства воды
Значительное количество аномальных свойств Воды (а их известно около 70) ученые объясняют тем, что жидкая вода (основной тип существования этого вещества на Земле) способен к образованию кластеров - скоплений, сгустков примерно по 100 молекул, структура которых напоминает структуру льда. Эти сгустки «плавают» в воде, структура которой менее упорядочена.
Температуры кипения и плавления воды аномально отличаются от температур кипения и плавления соединений Водорода с халькогенами (элементами главной подгруппы VI группы). Так, температура кипения Н2То составляет -4 °С, H2Se - -42 °С, H2S - -60 °С. В этом ряду температуры кипения последовательно снижаются, а у воды она составляет +100 °С.
Теплоемкость жидкой воды (4,2 кДж/кг · град) превышает теплоемкость всех других веществ (за исключением газообразного водорода).
Аномально изменяется плотность воды при охлаждении; при переходе из жидкого состояния в твердое она уменьшается, а для большинства неорганических веществ, наоборот, плотность увеличивается4. Наибольшая плотность воды при +4 °С равна 1 г/см3.
Вода имеет исключительно большое поверхностное натяжение (второй показатель после ртути, благодаря чему на границе воды и воздуха (по обе стороны) живет значительное количество водяных животных, возможен подъем воды по стволам деревьев на десятки метров), большую удельную теплоту испарения, плавления5, высокую диэлектрическую проницаемость.
Горячая вода в морозильнике при одинаковых условии замерзает быстрее холодной (эффект Мпемба). Ученые сегодня не могут объяснить этого феномена.
Сверхохлажденная вода. Химически чистая вода за отсутствия ядер кристаллизации (какими могли бы быть различные примеси) иногда не замерзает даже при температуре значительно ниже 0 °С. При температуре -38 °С любая вода превращается в лед. Аналогично существует и перегретая вода, которая превращается в пар при температуре выше 100°С.
Ученые различают как минимум 5 форм жидкой воды, 15 кристаллических (льда) и 3 модификации аморфной твердой воды. Например, при -120 °С лед становится тягучим, как мед, а при -135 °С и ниже превращается в стеклянную воду - твердое некристалічну вещество. Даже при отрицательных температурах лед ледников (кристаллическое вещество), проявляя пластичность, медленно «стекает» с гор вниз, как река.
Вода имеет память. Со многими веществами она образует кристаллогидраты, коллоиды. Вода - универсальный растворитель и катализатор (например, «сухой» бензин не горит; для этого он обязательно должен содержать какое-то количество воды)...
Еще больше меняются ее свойства вследствие воздействия на нее магнитного поля (например, закипает быстрее, а замерзает медленнее, чем обычная) или внутри капилляров. Внутри нанотрубок вода не теряет текучести и при температурах, которые близки к абсолютному нулю.
Интересно ведет себя вода внутри живых организмов. Большинство молекул находится в коллоидном (гелеобразному) состоянии. А на поверхности белков 2-3 слоя воды лежат на 10 % плотнее и движутся в 2-3 раза медленнее других. Фермента (белковом катализатора) для «включения» необходима водяная оболочка, которая покрывает 60-70 % его поверхности. ДНК для сохранения своей двойной спирали должна содержать воду (около трети массы молекулы ДНК).
Химические свойства воды
1. Вода взаимодействует с простыми веществами:
• с металлами:
а) с активными реагирует при нормальных условиях:
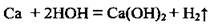
б) с другими металлами, которые расположены в ряду активности металлов левее водорода, вода взаимодействует при нагревании, то есть в виде водяного пара:
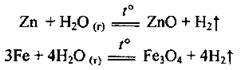
• с неметаллами:
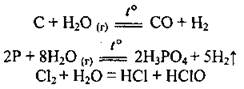
2. Вода взаимодействует с основными и кислотными оксидами:
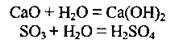
3. Со многими солями вода образует кристаллогидраты:
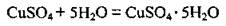 (медный купорос, купрум(II) сульфат пентагидрат)
(медный купорос, купрум(II) сульфат пентагидрат)
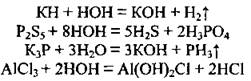
4. Вода разлагает бинарные солеподібні соединения, а также некоторые соли (происходит гидролиз):
5. С некоторыми веществами вода образует гидраты:
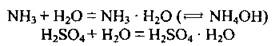
6. Вода участвует в фотосинтезе, который происходит в растениях на свету:
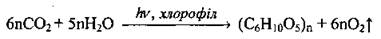
7. Вода взаимодействует с некоторыми органическими соединениями: алкенами, алкінами, эфирами, галогеноалканами:
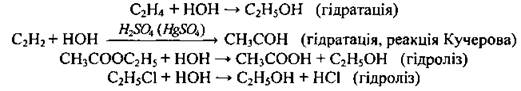
Значение воды
Физико-химическая уникальность этого природного соединения, необычное биологическое значение воды для жизни человечества и вообще всего живого нашли свое отражение в возникновении многоотраслевой науки гидрологии.
Без воды невозможно существование живых организмов. В любом организме она является средой, в которой происходят химические процессы, обеспечивающие его жизнедеятельность, и сама вода участвует во многих биохимических реакциях. Массовая доля воды в организме человека составляет около 70 %.
Немало воды нужно для эффективного сельского хозяйства. Обычно сельскохозяйственные культуры за вегетационный период потребляют до 4-5 т воды на гектар. На выращивание 1т картофеля необходимо 100 т, а 1 т зерна - 1000 т воды. Сельскохозяйственные территории в условиях недостаточности осадков (зоны рискованного земледелия) нуждаются в поливе.
Еще больше воды расходуют в промышленности, транспорте, строительстве. Воду используют для механического удаления примесей, как растворитель, как сырье. Особенно много воды требуют химическая промышленность, металлургические предприятия, текстильные фабрики, сахарные и крахмало-патокові заводы. Вода - незаменимый компонент практически всех технологических процессов. Например, на производство 1 т стали расходуется 300 т воды, 1 т бумаги - 900 т, 1 т химического волокна - более 2000 т.
Большое значение вода имеет в быту. Каждый взрослый человек ежедневно потребляет с пищей около 2 л воды. Значительно больше она тратит на бытовые нужды. В крупных городах расходы воды составляют около 100 л на человека в сутки. Не удивительно, что общий объем водоснабжения в Украине с учетом потерь достигает 30 км3 в год, что составляет 60 % всего стока наших рек.
______________________________________________________
1 Воздух всегда содержит водяной пар: при температуре 0 °С 1 м3 воздуха может вместить максимум 5 г воды, а при температуре +10 °С - уже 10 г.
2 Молекулы воды комет содержат вдвое больше Дейтерия, чем на Земле.
3 С помощью космического аппарата НАСА LCROSS 09. 10. 2009.
4 Кроме воды, таким свойством обладают висмут, галлий, некоторые соединения и смеси.
5 Так, удельная теплота плавления льда составляет 330 кДж/кг, а железа - 270 кДж/кг.