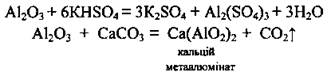8. Металлические элементы и их соединения. Металлы
8.4. Алюминий
Алюминий - элемент главной подгруппы III группы периодической таблицы, заряд ядра +13. Химический символ - Аl, относительная атомная масса - 27. Природный алюминий почти полностью состоит из единственного стабильного изотопа 27Аl со следами радиоактивного 26Аl.
Это металлический p-элемент. Характерный степень окисления - +3, а валентность - III; они соответствуют атому Алюминия в возбужденном состоянии:
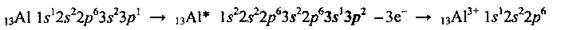
Распространенность в природе
Алюминий - самый распространенный в природе металлический элемент, по распространенности среди всех элементов занимает четвертое место (после Кислорода, Водорода и Кремния), не встречается в свободном виде. Содержание его в земной коре составляет 8,8 %.
Встречается в виде алюмосиликатов, которые составляют основную массу земной коры (ортоклаз KAlSi3O8, слюда, нефелін NaAlSiO4, каолин Аl2O3 · 2SiO2 · 2Н2O). Под действием дождей и углекислого газа алюмосиликаты звітрюються и образуется глина, основными компонентами которой являются каолин, песок, известняк и различные окислы Железа. К важнейших минералов Алюминия относят бокситы Аl2O3 · nН2O, криолит Na3AlF6 (залежи найдены только в Гренландии), корунд Аl2O3. Различают несколько разновидностей природного корунда: рубин (содержит примеси Сr2O3), сапфир (примеси ТiO2 иFe2O3) и другие.
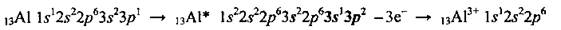 Извлечения алюминия
Извлечения алюминия
Алюминий получают электролизом алюминий оксида Аl2O3 (90%) в расплаве криолита Na3AlF6 (10%). Наличие криолита приводит к снижению температуры плавления алюминий оксида до 950 °С:
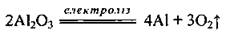
Физические свойства алюминия
Алюминий - серебристо-белый металл, легкий, легкоплавкий, имеет большую пластичность, хорошую тепло - и электропроводность, невысокую твердость. Алюминий покрыт прочной и плотной оксидной пленкой, толщина которой составляет 10-8 м.
Химические свойства алюминия
Алюминия характерна высокая химическая активность, но эта активность снижается вследствие пассивации. Во время химических реакций атом Алюминия проявляет только восстановительные свойства, он легко отдает три электрона и превращается в положительно заряженный ион: 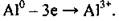
Алюминий взаимодействует:
1) с неметаллами:
• легко соединяется с кислородом воздуха. Образуется оксидная пленка, которая защищает его от дальнейшего окисления:
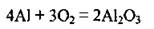
• с серой при нагревании образует алюминий сульфид (легко разлагается водой):
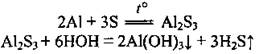
• с углеродом при довольно высокой температуры, образуя алюминий карбид (также легко разлагается водой):
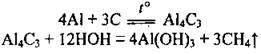
• с азотом при условии сильного нагрева, образуя алюминий нитрид (гидролизуется водой):
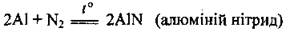
• с галогенами, образуя галогениды:
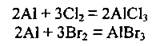
2) со сложными веществами:
• с водой (после снятия оксидной пленки):
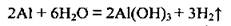
• с аммиаком:
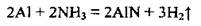
• с кислотами:
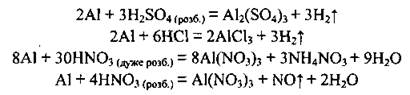
На холоде алюминий не взаимодействует с концентрированными серной и нітратною кислотами. При нагревании их взаимодействие возможно:
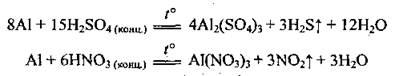
• с оксидами металлических элементов (во время нагрева):
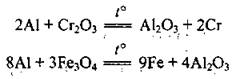
Смесь эквивалентных количеств Аl и Fe3O4 называют термітом. Процесс взаимодействия оксидов металлических элементов с алюминием при высокой температуре называют алюмінотермією;
• с щелочами. Если алюминий поместить в раствор щелочи, то сначала в лугу растворяется оксидная пленка, а затем происходит реакция (с образованием комплексной соли, Состав которой зависит от количества щелочи):

8.4.1. Алюминий оксид
Алюминий оксид - это белое твердое вещество, очень твердая, с температурой плавления 2000 °С.
Добыча алюминий оксида
1. Сжигания алюминия в атмосфере кислорода:
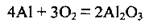
2. Термическое разложение алюминий гидроксида:
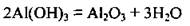
Свойства алюминий оксида Это амфотерный оксид. В воде не растворяется. Дышит свіжоосаджений алюминий оксид реагирует с кислотами и щелочами:
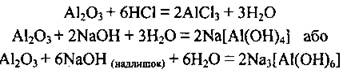
При сплава с щелочами образуются ортоалюмінати (Na3AlO3) или ліетаалюмінати (NaAlO2):
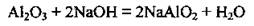
При его сплава с KHSO4, Na2CO3, СаСО3 образуются химически активные соединения Алюминия: